De tous les métaux, l’or est le seul à se parer de cette belle robe dorée qui le caractérise et que l’on croyait jadis d’essence divine. En réalité, le secret de sa couleur réside dans sa structure atomique, et plus exactement dans la couche superficielle d’électrons qui lui octroie des propriétés optiques exceptionnelles, en plus de lui conférer la particularité quasi unique de ne jamais s’oxyder ni de s’altérer avec le temps.
Voyage dans l’infiniment petit
Si vous imaginez encore qu’un atome est une sorte de petite bille autour de laquelle tourne une ou plusieurs autres billes plus petites à la manière d’un système solaire miniature, oubliez tout ça.
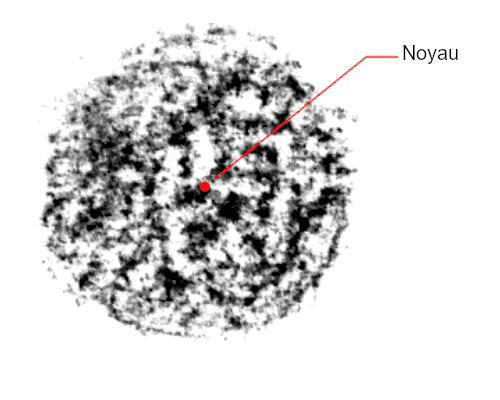
Aujourd’hui, on sait que la réalité n’a rien à voir avec cette représentation à la fois simpliste et contraire aux lois de la physique quantique. Un atome, c’est davantage une sorte de nuage de particules sub-atomiques, dont 99% de la masse est concentrée dans un noyau très dense — d’un diamètre 100 000 fois plus petit que celui du nuage atomique global — sous forme de protons et de neutrons.
Le reste du nuage autour du noyau est constitué d’électrons dont on ne connaît jamais précisément la position, notamment en raison de leur vitesse de déplacement (mais aussi de leur nature, à la fois onde et corpuscule). Tout ce que l’on sait pour chacun d’eux, c’est la probabilité qu’il ont de se trouver à telle ou telle position. Ce nuage électronique est donc plus “théorique” que vraiment visible.
Un électron est une particule en perpétuel mouvement, ce qui interdit toute détermination précise de sa position.
De la même façon, son déplacement autour du noyau s’inscrit dans une distribution de probabilité plutôt que suivant une orbite bien définie.
Sur l’image, les zones les plus foncées correspondent aux endroits où l’électron a le plus de chances de se trouver.
Du reste — et c’est ce qui va nous intéresser —, tous ces électrons, dont le nombre va de 1 pour l’hydrogène à 124 pour l’hypothétique Unbiquadium, se répartissent selon des “couches” appelées aussi des orbitales atomiques. Il peut y avoir ainsi jusqu’à sept couches, selon les atomes, chacune constituée de une à quatre sous-couches. La couche la plus externe est appelée la couche de valence, et ce sont les électrons qui la composent qui sont susceptibles d’intervenir dans l’établissement des liaisons chimiques avec d’autres atomes pour former une molécule.
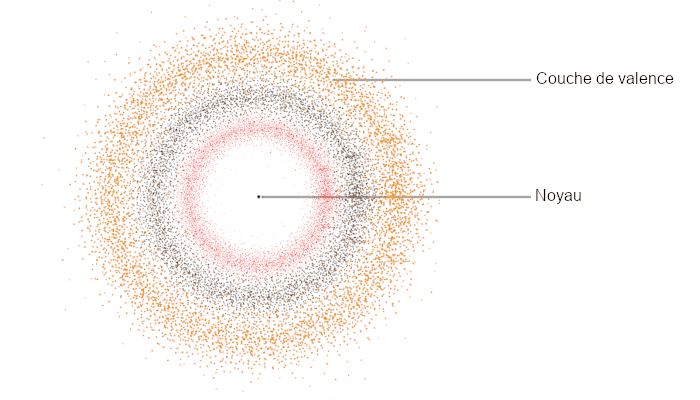
C’est aussi, d’une certaine manière, cette couche électronique externe qui donne la couleur de l’élément chimique concerné. L’atome d’or par exemple possède 79 électrons : 2 pour la première couche, 8 pour la deuxième, 18 pour la troisième, 32 pour la quatrième, 18 pour la cinquième, et un seul sur la sixième, la fameuse couche externe.
De l’or bien jaune
Ce qui précède vaut pour tous les atomes et en particulier pour les métaux. Quand la lumière frappe la surface d’un métal, les photons (les particules élémentaires de la lumière) interagissent avec les atomes qui forment cette surface, et plus exactement avec les électrons de la couche externe de ces atomes. Plus libres que les électrons des couches plus profondes du nuage atomique, ces électrons de surface s’excitent au contact des photons qui sont des particules porteuses d’énergie. Sans entrer dans les détails et de manière très simplifiée, disons que les électrons vont absorber tout ou partie des photons qui arrivent, ce qui les fait fugitivement changer de niveau d’énergie (ils se “chargent”). Ils doivent alors réémettre les photons pour retrouver leur niveau d’énergie initial.
Pour la plupart des métaux, cette absorption/émission s’opère sans véritable sélection dans presque toutes les longueurs d’onde du spectre visible, ce qui leur donne une apparence grise ou argentée plus ou moins foncée.
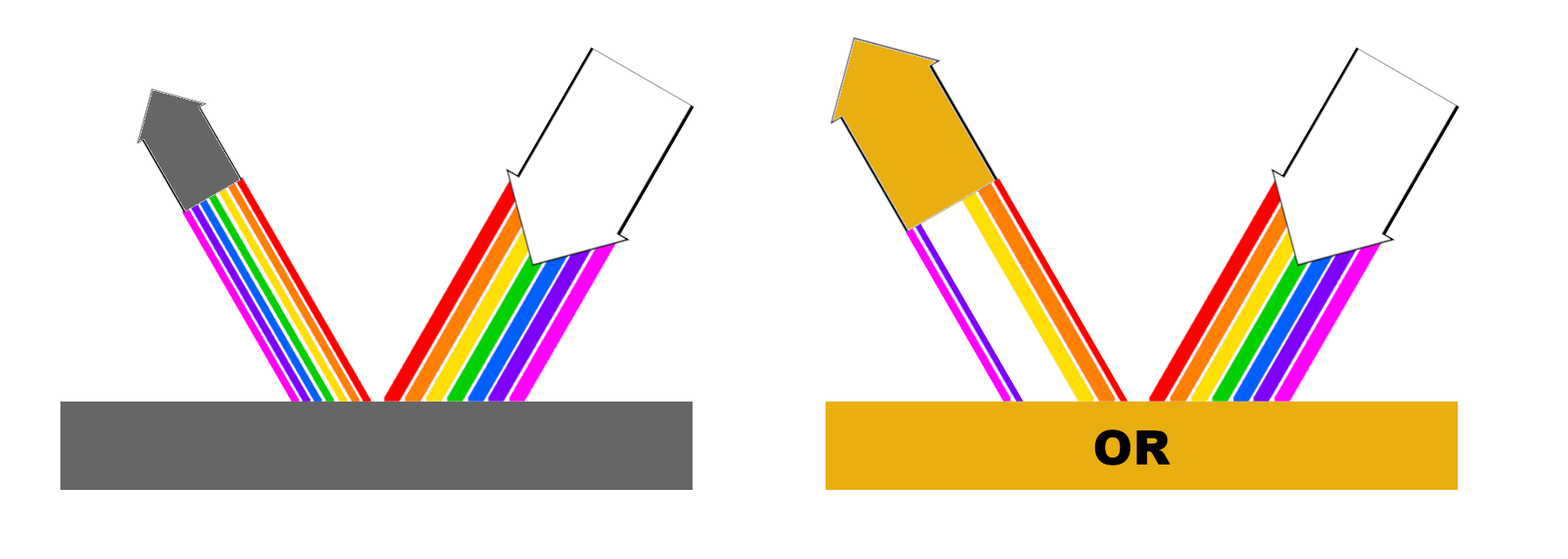
Pour l’or en revanche, le processus est légèrement différent en raison de ses propriétés électroniques uniques. En effet, l’or a une bande d’absorption relativement étroite et beaucoup plus sélective, principalement dans le domaine du bleu-vert du spectre visible. En clair, cela signifie que les électrons à la surface de l’or absorbent uniquement la lumière dans ces longueurs d’onde spécifiques et renvoient toutes les autres longueurs d’onde plus longues (rouge, orange et jaune) ainsi que celles plus courtes (violet) qui, combinées, donnent cette couleur dorée caractéristique.
Car, rappelons-le, la couleur d’un objet est dûe aux longueurs d’onde de lumière qu’il réfléchit.
De l’or bien brillant
Nous savons donc maintenant pourquoi l’or nous apparaît sous cette teinte si caractéristique, mélange de jaune orangé légèrement patiné de violet. Mais pourquoi brille-t-il ?
Cette fois, c’est lié à deux caractéristiques bien distinctes. La première tient en la structure atomique de l’or dont les atomes sont empilés selon une configuration dite « cubique à faces centrées ». C’est une structure cristalline très stable qui donne des matériaux aux surfaces très lisses et particulièrement réfléchissantes.
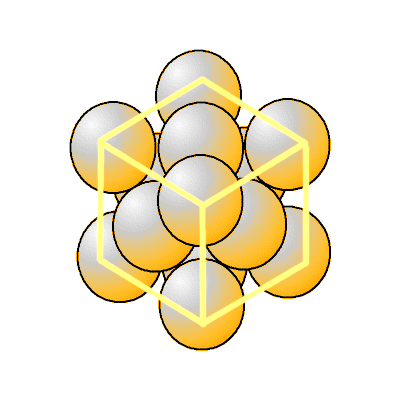
Mais l’or a une deuxième propriété très particulière qui peut expliquer sa “brillance” naturelle. En effet, les électrons libres à la surface de l’or sont perpétuellement agités et forment une sorte de “brouillard électronique” que l’on appelle un plasma, c’est-à-dire un état particulier de la matière qu’on pourrait assimiler à un gaz ionisé dans lesquels les électrons (de charge négative) interagissent en permanence avec les ions de charge positive de leur environnement. Ou avec des photons.
Un plasma d’électrons a une fréquence de résonance naturelle, propre à chaque élément, et dans le cas de l’or cette résonance s’exprime dans le domaine du spectre visible. La « vibration » qui en résulte joue donc un rôle dans la perception de la couleur dorée qui semble alors “scintiller”.
Ce qu’il faut retenir
- L’or est le seul métal de cette couleur.
- Le secret de sa couleur réside dans sa structure atomique.
- Les électrons d’un atome d’or évoluent autour du noyau en se répartissant sur plusieurs couches dont la dernière est celle qui réagit avec les particules élémentaires de lumière (photons).
- Contrairement à ce qui se passe pour la quasi-totalité des autres métaux, les électrons de la couche externe des atomes d’or absorbent seulement une toute petite partie de la lumière visible (le bleu et le vert) et renvoient toutes les autres longueurs d’ondes du spectre lumineux, ce qui donne à l’or sa couleur si caractéristique.
- Une sorte de brouillard de gaz ionisé (plasma) vibre constamment dans la lumière visible à la surface des atomes d’or, contribuant à sa couleur mais aussi à son apparence “chatoyante”.
Auteur et consultant depuis plus de vingt ans dans le domaine de la communication stratégique, il a plusieurs fois travaillé pour le compte d'entreprises financières dont il décrypte aujourd'hui les coulisses et les mécanismes économiques de base à l'intention du plus grand nombre.


Encore moi !
j’avais quand même en tête quelques vieux restes de mes cours de physique chimie….
et votre réponse m’ayant laissé perplexe, j’ai consulté l’I.A. :
https://chatgpt.com/share/64e95b81-cb1c-4ab6-a237-85587a541dcf
quelle est la couleur d’une feuille d’or par transparence ?
ChatGPT
Lorsqu’une feuille d’or est extrêmement mince, elle devient partiellement transparente. Par transparence, la couleur de la lumière qui traverse une feuille d’or fine apparaît généralement vert-bleuâtre. Cette coloration est due à l’absorption de la lumière dans le rouge et l’infrarouge par l’or, laissant passer principalement les longueurs d’onde dans la partie bleue et verte du spectre visible.
Cela reste maintenant à essayer en travaux pratiques !
Bien cordialement,
Jean-Marie
Bonjour,
Vous avez bien fait de procéder à vos propres recherches, c’est une saine réaction devant toute publication. D’abord parce que nul n’est à l’abri d’une erreur (et c’est bien de vérifier), et ensuite parce que le résultat de vos propres investigations viendra sans nul doute enrichir les connaissances de nos lecteurs en marge de ce que nous avons écrit. Une perspective qui nous réjouit car l’une de nos préoccupations permanentes est d’informer en vulgarisant au maximum pour que chacun ait accès aux savoirs qui nous paraissent utiles ou importants.
Merci donc de nous y aider.
Bien cordialement également.
Est-ce qu’un feuille d’or suffisamment mince laisserait passer le spectre vert-bleu par transparence ? (le reste du spectre étant réfléchi en surface)
Bonjour Jean-Marie
En réalité, l’absorption de la lumière est un phénomène électromagnétique au cours duquel les photons interagissent avec les électrons des atomes de la matière. Lorsque c’est le cas, l’énergie des photons est « simplement » transformée en une autre sorte d’énergie qui affecte provisoirement les électrons (par exemple en les faisant changer de niveau d’énergie autour du noyau). Tout ce qui n’est pas absorbé « rebondit », tout ce qui est absorbé est transformé. Rien ne ressort de « l’autre côté », et donc même une couche extrêmement mince d’or ne permettrait pas le passage d’une raie bleu-vert par transparence. Car la lumière concernée, celle qui est absorbée, a été transformée en une autre forme d’énergie.
Dans les faits, le mécanisme physique est beaucoup plus complexe et certains de ses aspects font intervenir la mécanique quantique, mais dans l’ensemble c’est plus ou moins ce qu’il se passe.
Quoi qu’il en soit, merci de votre intérêt pour cet article. J’espère avoir répondu à votre interrogation.